
Japanese writer and publicist based in Eindhoven, The Netherlands
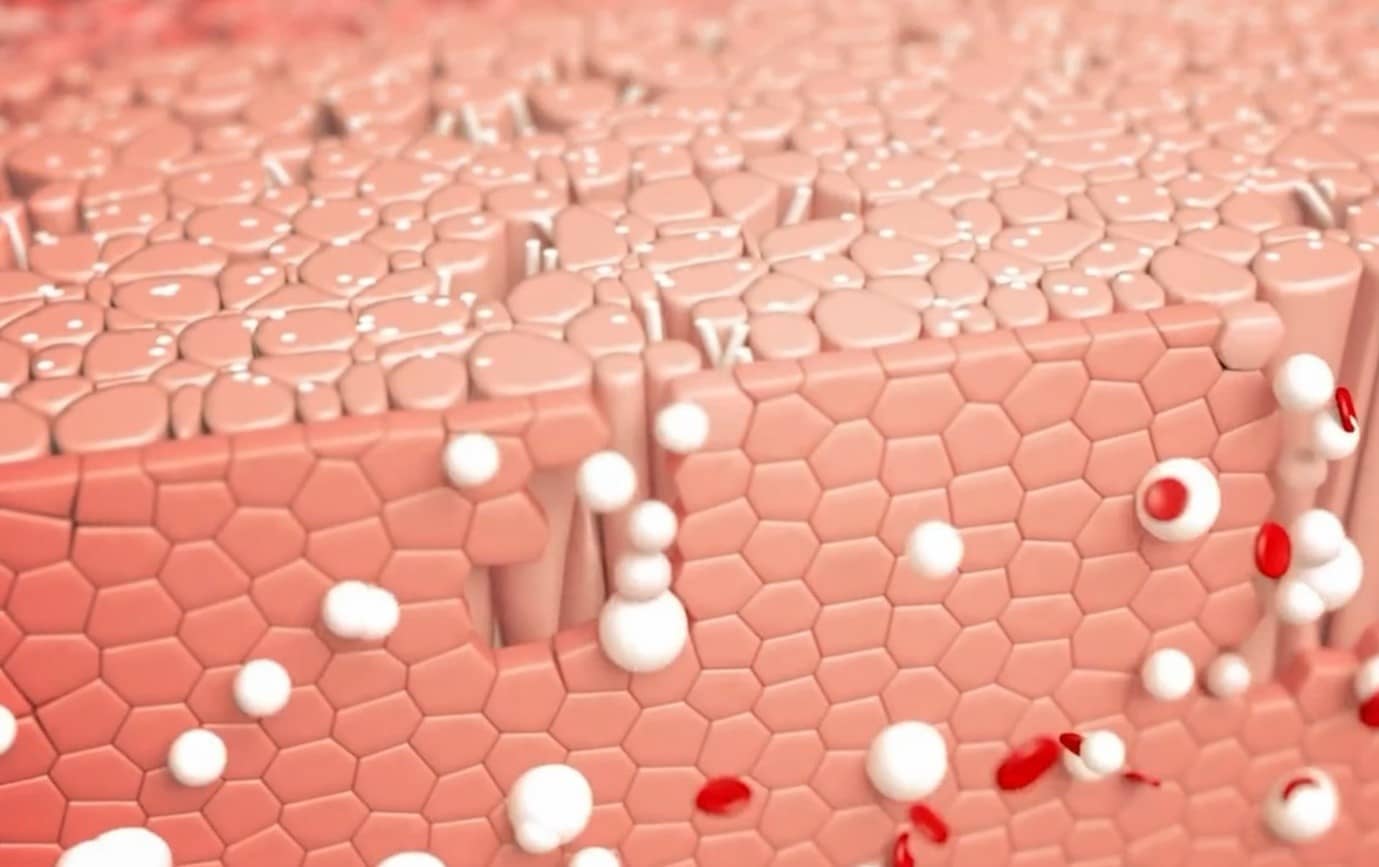 生体材料の上で組織化する細胞。オランダ南部のブラバント州では、再生医療に使われる生体材料の工業生産を計画している。(資料:STENTiTビデオより)
生体材料の上で組織化する細胞。オランダ南部のブラバント州では、再生医療に使われる生体材料の工業生産を計画している。(資料:STENTiTビデオより)
医学の進歩により多くの命が救われるようになりましたが、糖尿病や変形性関節症、閉塞性動脈硬化症、慢性腎不全、アルツハイマー症など、慢性疾患を抱えながら長生きする人が増えているのも事実です。
現在のヘルスケアでは、慢性疾患の症状をやわらげたり、病気の進行を遅らせたりすることが主軸となっていますが、そうしたアプローチは実はコストが高く、労働集約的で、長期的にサステイナブルではありません。
「次世代の医療」と言われる再生医療は、こうした問題への解決法として注目されています。
再生医療は、「幹細胞」と呼ばれる特殊な細胞を用いて、組織や臓器の欠損や機能障害・不全を再生することで失われた機能の回復を目指すもので、先述した糖尿病など、これまで治らないと言われていた慢性疾患の治療法として期待されています。
しかし、現在のところ再生医療は手間やコストがかかりすぎるため、世界的に見ても一般に普及していないのが現状です。オランダではこれを患者の手の届く医療にしようと、幹細胞や組織、生体材料を大量生産できる仕組みづくりに乗り出しています。
 TU/eでは心臓の人工弁の足場となる生体材料を開発した。(資料:Xeltisビデオより)
TU/eでは心臓の人工弁の足場となる生体材料を開発した。(資料:Xeltisビデオより)
例えば、オランダ南部ブラバント州にあるアイントホーフェン工科大学(TU/e)では、心臓弁膜症などで機能しなくなった心臓弁を人工弁に置き換える方法を研究しています。
人工弁は子どもの身体に移植した場合、身体の成長に伴って成長しないため、リスクの高い手術を繰り返さなければならないという問題があります。しかし、TU/eでは生きた細胞とバイオマテリアル(生体材料)を組み合わせ、人工弁を成長可能にすることで、これを解決しようとしています。
TU/eではそれを実現するため、細胞が接着し、心臓弁組織へと増殖するための足場となる新たな繊維素材を開発しています。同大学のJan van Hest(ヤン・ファンへスト)教授によると、その素材は、複数の分子が「非共有結合性相互作用」という弱い結合により、ゆるく結びついてできる「超分子材料」の基礎研究から発生しています。
「相互作用のダイナミクスによって、その材料は変化し、周りの環境に適応することもできるのです。それはまさに、身体に必要なものです」(ファンへスト氏)。
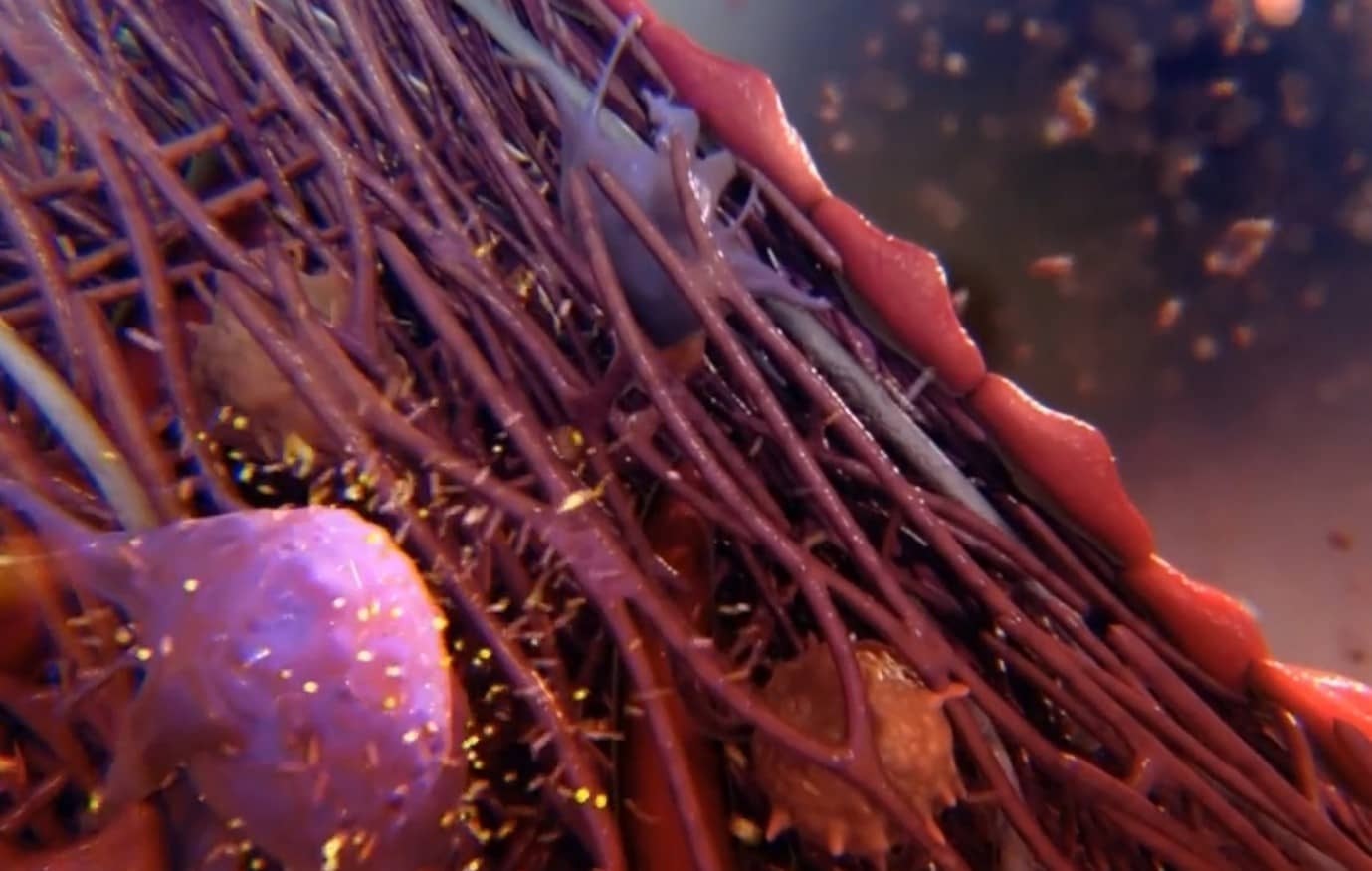 人工の足場材料に生きた細胞が接着し、心臓弁の組織に成長する。(資料:Xeltisビデオより)
人工の足場材料に生きた細胞が接着し、心臓弁の組織に成長する。(資料:Xeltisビデオより)
この基礎研究に基づいて、エンジニアが繊維材料を開発し、複合材料に加工。それは、TU/eからスピンオフしたスタートアップ企業「Xeltis(クセルティス)」により製品化されました。クセルティスでは臨床実験も行っており、すでに成功例も見られます。
このほかにもTU/eの別の学部からのスピンオフとして「STENTiT(ステンティット)」という企業もあり、そこでは生分解性の再生血管内インプラントを開発しています。
「次のステップは、こうしたテクノロジーをより多くの人にアクセス可能にすることです」(ファンへスト氏)。
アイントホーフェンのプロジェクトで中心的な役割を果たしているのは、「スマート・バイオマテリアルズ・コンソーシアム(SBMC)」。クセルティス、ステンティット、そして日本の富士フィルム株式会社を含む40以上の企業や研究機関がメンバーとして名を連ねており、これら企業・組織のコラボレーションを促進し、新たな生体材料や生分解性材料の開発をサポートしています。
SBMCマネージング・ディレクターのJan Rietsema(ヤン・リーツマ)氏によれば、同組織が注力するのは、水を内部に含むゲル状の物質であるハイドロゲルと、先述の人工弁を含む、生分解性インプラントです。
「ハイドロゲルは、細胞培養を加速し、薬物または細胞・組織を体内に送達するために使用されます。生分解性インプラントは、体内の新しい機能組織の成長をサポートするために特別に構築された生体材料です。 体内で溶けるので、外科的に取り除く必要はなく、患者への負担が大いに軽減されます」(リーツマ氏)。
 SBMCマネージング・ディレクターのJan Rietsema(ヤン・リーツマ)氏
SBMCマネージング・ディレクターのJan Rietsema(ヤン・リーツマ)氏
現在、SBMCは2つのプロジェクトに取り組んでいます。そのうちの1つは、メンバー企業が新たな生体材料を開発するための施設。生体材料の上で細胞がどのように反応するかを実験したり、製品をテストしたりする設備があります。
もう1つのプロジェクトは、アイントホーフェン市内にある「Brainport Industry Campus(BIC:ブレインポート産業キャンパス)」に、生体材料と生分解性インプラントのパイロットラインを開設するというもの。2023年には細胞を加工・培養するためのクリーンルームを建設、2024年にはオープンを予定しています。
「すべてが臨床的に検証され、GMP(医薬品の製造管理および品質管理の基準)の厳しい条件下で製造されなければなりません。また、世界中に出荷するためには、ロジスティクスも考慮しなければなりません」(リーツマ氏)
SBMCが想定するビジネスモデルは、ハイドロゲルを主とした生体材料や生分解性インプラントの受託開発、受託製造、および製品開発と生産技術に関する規制のアドバイスとサポートの提供などです。
「SBMCでは新しい生体材料や生分解性インプラントを開発したい組織、材料や3Dプリンティング、エレクトロスピニングなどの技術を持つ企業、再生医療分野に注力する医療関連企業など、さまざまなプレーヤーの協力を求めています」(リーツマ氏)。
 アイントホーフェン市にあるBrainport Industry Campus(BIC)には、さまざまな企業の開発・製造拠点がある。(Brainport Industries Campusビデオより)
アイントホーフェン市にあるBrainport Industry Campus(BIC)には、さまざまな企業の開発・製造拠点がある。(Brainport Industries Campusビデオより)
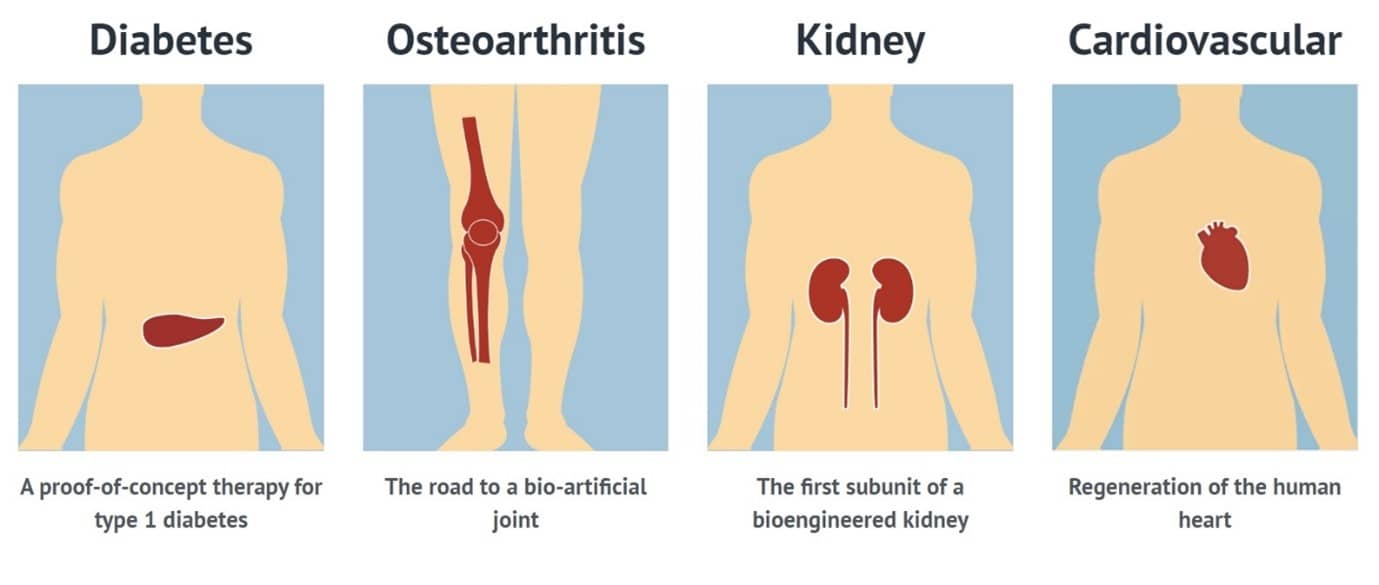 RegMed XB は現在、1型糖尿病、腎不全、変形性関節症、心血管疾患の治療法開発に注力している。(RegMed XBのホームページより)
RegMed XB は現在、1型糖尿病、腎不全、変形性関節症、心血管疾患の治療法開発に注力している。(RegMed XBのホームページより)
アイントホーフェンのパイロットライン計画は、実はオランダで全国的に広がる再生医療普及計画の一角を成すものです。再生医療を患者の手の届くものにしようという動きは、オランダとベルギーの大学・研究機関、企業、政府組織が集まって結成した「再生医療クロッシングボーダー(RegMed XB)」というパートナーシップ組織に結実しています。
参加メンバーは、世界中で増加している1型糖尿病、腎不全、変形性関節症、心血管疾患といった慢性疾患に対する再生医療を普及させるため、「ムーンショット」と銘打った長期ビジョンを共有。オランダで再生医療のためのインフラを構築しようとしています。
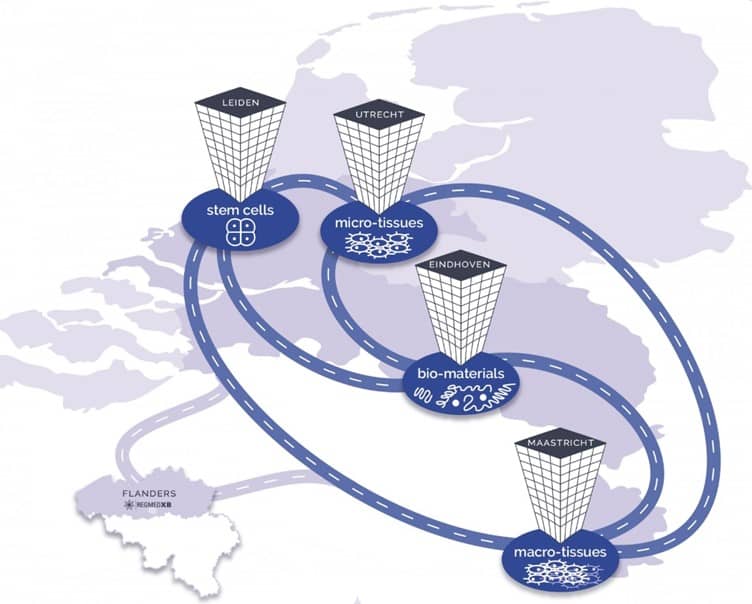
オランダではライデン、ユトレヒト、アイントホーフェン、マーストリヒトの4カ所で再生医療のパイロットラインを開設予定。(RegMed XBのホームページより)
現在、計画が進められているのは、オランダの4地域におけるパイロットラインの開設です。4地域とは、ライデン、ユトレヒト、マーストリヒト、そしてアイントホーフェン。
「ライデン・バイオサイエンスパーク」では幹細胞の生産、「ユトレヒト・サイエンスパーク」では微小組織(オルガノイド)、「マーストリヒト・ヘルス・キャンパス」ではより複雑なマクロ組織(臓器)、アイントホーフェンでは前述のように生体材料と生分解性インプラントに焦点を当てています。
向こう3年間でこれらのパイロットラインを構築するため、オランダ政府は2021年9月、5600万ユーロ(約82億円)を投じることを発表しました。再生医療のインフラ構築に向けた動きはまだ始まったばかりですが、着実に進行しています。
再生医療にはいろいろな形がありますが、現在、日本の多くの医療機関で行われているのは、自分の身体から「体性幹細胞」といわれる、決まった組織や臓器で細胞をつくり続けている幹細胞を取り出して増やし、もとの身体に戻すというものです。変形性関節症や脳梗塞による機能障害の回復、閉塞性動脈硬化症などの治療法として、こうした再生医療がすでに提供されています。
一方、ノーベル賞を受賞した京都大学iPS細胞研究所の山中伸弥教授が開発した「iPS細胞」は、皮膚などの細胞に遺伝子を組み込んでつくられる細胞で、さまざまな生体組織への成長ができる多機能性幹細胞です。日本は同細胞に関する再生医療の研究が盛んで、2014年には世界で初めてiPS細胞を用いて作った網膜色素上皮細胞の移植手術も行われました。この細胞は病気の原因究明や新薬の開発にも応用されています。
 オープンラボで実験を行う様子 (写真:京都大学iPS細胞研究所)
オープンラボで実験を行う様子 (写真:京都大学iPS細胞研究所)
iPS細胞のほかには、受精卵の一部に属する内部細胞塊からつくられる「ES細胞」も多能性幹細胞です。これはiPS細胞と同様、理論上、すべての組織に分化できる分化多能性を持ち、ほぼ無限に増殖させることができる万能細胞で、欧米ではこちらの細胞を用いた再生医療の研究が盛んです。
再生医療について、日本では2014年11月から「再生医療等安全確保法」が施行され、治療の際の手続きや細胞培養加工の外部委託についてルールが設けられました。また、一部の治療については国民保険が適用されることになりました。
しかし、多くのケースはまだ保険が適用されておらず、自費で治療する場合は数百万円から高いものでは1千万円以上の高額な医療費がかかります。慎重な手作業で行われている現在の再生医療は、ごく一部の限られた人たちへの医療となっています。
「再生医療を患者の手の届くものにする」という課題に対し、オランダはすでに動き出しています。製品・技術開発だけでなく、規制のあり方や品質管理、ロジスティクス、サプライチェーン構築、人材育成など、これから解決するべき多くの課題に向け、オランダでは日本の研究機関や企業の協力も求めています。
ケアから治療へ――私たちの医療は今、転換期を迎えています。「人生100年時代」の健康を支える再生医療を普及させるために、一緒に挑戦してみませんか?皆さまのご連絡をお待ちしております。
Jan Rietsema, SBMC Managing Director
jan.rietsema@smartbiomaterials.nl